Две группы биофизиков независимо друг от друга применили флуоресцентный наноскоп для исследования движения белка кинезина-1 по микротрубочкам цитоскелета. Одна группа ученых подробно изучила конформации шагающего кинезина, а другая смогла проследить за прогулкой белка по микротрубочкам in vivo.
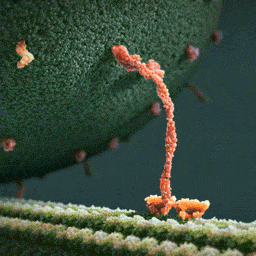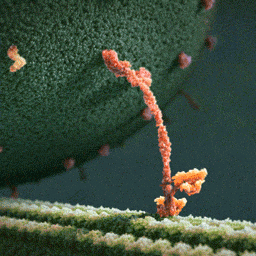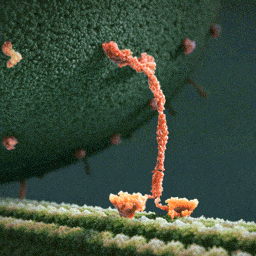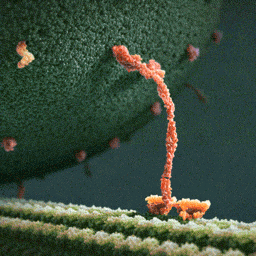
Кинезины – это семейство моторных белков, которые умеют перемещаться по микротрубочкам цитоскелета клетки. Причем их движение очень напоминает шаги человека. Главная функция этих белков – это клеточный транспорт. Они умеют связываться с другими молекулами и переносить их в разные части клетки. При этом энергию эти белки получают за счет гидролиза АТФ.
По сути кинезины представляют собой молекулярные машины внутри живого организма. Но подробно наблюдать за их движением под микроскопом ученые так и не научились. Дело в том, что обычные световые микроскопы ограничены дифракционным пределом и не могут фокусировать свет на нанометровых объектах. А более точные микроскопы – например, атомно-силовой микроскоп, неприменимы для исследования живых клеток.
А вот флуоресцентные микроскопы высокого разрешения (наноскопы), за которые в 2014 году трем ученым дали Нобелевскую премию по химии, могут работать в живых клетках. Но даже самые продвинутые флуоресцентные наноскопы редко дают рассматривать объекты размером меньше 20 нанометров, а уж тем более следить за их движением. И чтобы проследить за белком размером в несколько нанометров, ученым пришлось использовать самые новые технологии.
Так, в 2017 году физики из Германии под руководством одного из Нобелевских лауреатов 2014 года Штефана Хелля (Stefan Hell) сообщили об изобретении флуоресцентного наноскопа MINFLUX с разрешением в несколько нанометров. Принцип его работы был основан на поиске минимума флуоресценции. Идея была в том, что интересующая ученого молекула-флуорофор в темном центре кольцеобразного пучка света не флуоресцирует – и этот минимум флуоресценции можно найти с очень высокой точностью. А при небольшом смещении относительно центра пучка молекула попадает под интенсивное излучение и начинает флуоресцировать – в этот момент «бублик» света смещается вслед за молекулой так, чтобы его темный центр снова находился над ней. И после многих итераций смещения молекулы и поиска минимума флуоресценции получается траектория движения нанометрового объекта в двумерном или трехмерном пространстве.
Недавно две группы биофизиков решили применить микроскоп MINFLUX для исследования движения кинезина-1 в клетках. Одна группа под руководством Йонаса Риса (Jonas Ries) из Европейской молекулярно-биологической лаборатории исследовала движение кинезина в живых клетках человеческой остесаркомы U2OS и в аксонах кортикальных нейронов мышей. В клетках обоих типов ученые зафиксировали шаги кинезина длиной около 8 нанометров и заметили, что некоторые молекулы белка могут перепрыгивать на соседние протофиламенты или даже между микротрубочками, если сталкиваются с препятствиями или дефектами в структуре их «дороги».
А другая группа ученых под руководством ранее упомянутого Стефана Хелля из Института медицинских исследований Общества Макса Планка с помощью MINFLUX подробно исследовала шаги кинезина. Авторы исследования приготовили кинезин с флуоресцентной меткой на одной из спиралей его стебля и обнаружили, что он делает небольшие шаги разной длины – 6 и 10 нанометров. Такую асимметрию ученые связали с тем, что во время каждого шага происходит изменение конформации стебля, на котором держатся две головки кинезина. А из-за того, что метка есть только на одной из спиралей, измеренная длина шагов оказывается разной. Это предположение удалось подтвердить с помощью экспериментов с флуоресцентными метками на обеих спиралях стебля. Также авторы статьи надежно показали, что связывание АТФ с кинезином происходит в момент, когда белок держится на микротрубочке только одной из своих головок.
Так две группы ученых смогли исследовать движение молекулы белка под микроскопом. Одна группа достигла разрешения в несколько нанометров in vivo, а другая – разрешения в 0,6 нанометра в близких к физиологическим условиях. Обе группы биофизиков считают, что разработанный ими метод – самый точный из существующих для трекинга движения белков и других больших молекул.
Cтатьи (раз, два) опубликованы в журнале Science
Источник: Михаил Бойм nplus1.ru









